1. 실제가스에 관한 설명 중 틀린 것은?
① 압축인자는 압축인자는 항상 1보다 작거나 같다.
② 혼합가스의 2차 비리얼 (virial)계수는 온도와 조성의 함수이다.
③ 압력이 영(zero)에 접근하면 잔류 (residual)엔탈피나 엔트로피가 영(zero)으로 접근한다.
④ 조성이 주어지면 혼합물의 임계치 (Tc, Pc, Zc)는 일정하다.
① - 실제기체의 압축인자는 항상 1보다 크다. 압축인자가 1일때는 이상기체이다.
② - 보통 1차든 2차든 비리얼 계수는 온도만의 함수이다. 하지만 혼합가스의 2차 비리얼 계수는 온도와 조성의 함수이다. 이 표현을 알아둬야 한다.
③ - 잔류성질은 이상기체와 실제기체의 차이라고 한다.(잔류성질 = 실제기체 - 이상기체) 이상기체가 되는 조건이 고온저압이기 때문에 압력이 영에 근접하면 이상기체에 가까워지기 때문에 잔류성질들은 0으로 접근한다.
④ - 임계치들은 항상 일정하다.
답은 1번
2. 일반적인 삼차 상태방정식 (Cubic Equation of State) 의 매개변수를 구하기 위한 조건을 옳게 표시한 것은?

잘모르겠다.
답은 3번

잘모르겠다ㅠㅠ 퓨개시티는 봐도봐도 새롭다ㅠㅠ
답은 4번
4. 기-액상에서 두 성분이 한가지의 독립된 반응을 하고 있다면, 이 계의 자유도는?
① 0
② 1
③ 2
④ 3
F = c - p + 2
F = 1 - 2 + 2 = 1
답은 2번
5. 다음 중 일의 단위가 아닌 것은?
① N·m
② Watt·s
③ L·atm
④ cal/s
우선 기체상수의 단위를 생각해보면 8.314 J / mol * K이다. 즉, nRT 의 단위가 J(일의 단위)가 된다. PV = nRT이기 때문에 자연스럽게 PV도 일의 단위가 된다.
① W=F*s(힘*이동거리) 이기 때문에 N*m은 일의 단위이다.
② 와트는 일률로 일을 시간으로 나눈 것이다. 때문에 Watt * s은 일의 단위가 된다.
③ L*atm은 부피*압력이다. 즉 PV이기 때문에 일의 단위가 맞다.
④ 칼로리는 물1g을 1도 올리는데 필요한 열량을 의미한다. 그렇기 때문에 일의 단위가 되려면 cal/(s*도)가 되어야 한다.
답은 4번
6. 다음 중 에너지의 출입은 가능하나 물질의 출입은 불가능한 계는?
① 열린계 (Open system)
② 닫힌계 (Closed system)
③ 고립계 (Isolated system)
④ 가역계 (Reversible system)
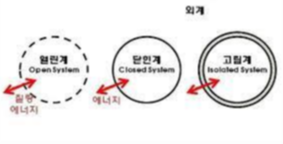
위의 그림이 가장 잘 설명되어 있다. 열린계 -> 닫힌계 -> 고립계 이 순서대로 더 닫혀있다고 생각하면된다. 따라서 답은 닫힌계
답은 2번

8. 다음의 반응에서 반응물과 생성물이 평형을 이루고 있다. 평형이동에 미치는 온도와 압력의 영향을 살펴보기 위해서, 온도를 올려보고 압력을 상승시키는 변화를 주었을 때 평형은 두 경우에 각각 어떻게 이동하겠는가? (단, 정반응이 흡열반응이다.)

① 온도 상승 : 오른쪽, 압력상승 : 오른쪽
② 온도 상승 : 오른쪽, 압력상승 : 왼쪽
③ 온도 상승 : 왼쪽, 압력상승 : 오른쪽
④ 온도 상승 : 왼쪽, 압력상승 : 왼쪽
정반응이 흡열반응이기 때문에 온도가 상승하면 반응이 오른쪽으로(정반응) 일어난다.
반응전과 후의 반자수의 비는 1:2이다. 압력을 상승시키면 분자수를 줄이려고하는 반응이 일어나기 때문에 왼쪽으로(역반응) 일어난다.
답은 2번
9. 열역학 모델을 이용하여 상평형 계산을 수행하려고 할 때 응용 계에 대한 모델의 조합이 적합하지 않은 것은?
① 물 속의 이산화탄소의 용해도 : 헨리의 법칙
② 메탄과 에탄의 고압 기·액 상평형 : SRK(Soave/Redlich/Kwong) 상태방정식
③ 에탄올과 이산화탄소의 고압 기·액 상평형 : WILSON 식
④ 메탄올과 헥산의 저압 기·액 상평형 : NRTL(Non-Random-Two-Liquid)식
① - 헨리의 법칙이 기체의 용해도와 관련된 식이기 때문에 맞다.
② -
③
④
10. 공기표준디젤사이클의 P-V 선도에 해당하는 것은?

오토기관, 디젤기관, 공기표준(기체 터빈) 선도를 알아둬야 한다.
답은 3번
11. 일정압력(3kgf/cm2)dp에서 0.5m3의 기체를 팽창시켜 24000kgf·m의 일을 얻으려 한다. 기체의 체적을 얼마로 팽창해야 하는가?
① 0.6m3
② 1.0m3
③ 1.3m3
④ 1.5m3
12. 평형상태에 대한 설명 중 옳은 것은?
① (dGt)t,p >0 가 성립한다. ② (dGt)t,p <0가 성립한다.
③ (dGt)t,p =1이 성립한다. ④ (dGt)t,p =0이 성립한다.
13. 1atm, 357℃의 이상기체 1mol을 10atm으로 등온압축하였을 때의 엔트로피 변화량은 약 얼마인가?(단, 기체는 단원자분자이며, 기체상수 R=1.987cal/mol·K이다.)
① -4.6cal/mol·K ② 4.6cal/mol·K
③ -0.46cal/mol·K ④ 0.46cal/mol·K
14. 500K의 열저장소(Heat Reservoir)로부터 300K의 열저장소로 열이 이동된다. 이동된 열의 양이 100kJ이라고 할 때 전체 엔트로피 변화량은 얼마인가?
① 50.0kJ/K ② 13.3kJ/K
③ 0.500kJ/K ④ 0.133kJ/K
15. GE가 다음과 같이 표시된다면 활동도계수는? (단, GE는 과잉 깁스에너지, B, C는 상수, γ 는 활동도계수, X1, X2 : 액상 성분 1, 2의 GE/RT=BX1X2+C
① lnγ1=BX22 ② lnγ1=BX22+C
③ lnγ1=BX12+C ④ lnγ1=BX12
16. 이상기체의 단열가역 변화에 대하여 옳은 것은?(단, γ=Cp/Cv 이다.)